Sulfur d'idrogèn
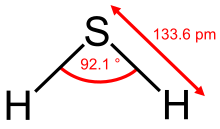
Lo sulfur d'idrogèn es un compausat quimic compausat d'idrogèn e de soupre que sa formula generala es H2S. Dins lei condicions normalas de temperatura e de pression, es un gas incolòr, toxic, inflamable e caracterizat per una odor d'uòu porrit. Sa solubilitat dins l'aiga es febla mai pòu reagir amb de solucions basicas e de metaus, compres d'aliatges, coma l'argent ò l'acier. Es un compausat naturau de petròli e de gas volcanic. Pòu tanben èstre produch per d'activitats indústrialas umanas.
Produccion e sintèsi
modificarDins la natura
modificarDins la natura, lo sulfur d'idrogèn es emés per lei volcans en quantitats importantas. Es tanben produch per la degradacion dei proteïnas contenent de soupre per de bacterias sulforeductritz ò adaptadas a la subrevida dins de mitans pauc oxigenats. Aquò explica l'odor fetida deis excrements, dei gas intestinaus ò dei cadabres[1].
Procès artificiau
modificarLa sintèsi dau sulfur d'idrogèn es generalament realizada en doas etapas a partir d'una mescla de pouvera de soupre e de limalha de fèrre. Premier, aquela mescla es cremat dins una copèla per obtenir de sulfur de fèrre (II). Puei, una addicion d'acid sulfuric permet de produrre un desgatjament gasós de sulfur d'idrogèn[2]. Un autre metòde de fabricacion es basat sus la reaccion entre lo sulfur d'alumini Al2S3 e l'aiga.
Utilizacions
modificarAu començament dau sègle XXI, lo sulfur d'idrogèn a pauc d'aplicacions. Es de còps utilizat dins la sintèsi de compausats organosouprats coma lei tiòls. Pòu tanben èsser utilizats amb de metaus alcalins per produrre d'idrosulfurs e de sulfurs alcalins, coma l'idrosulfur de sòdi NaHS, qu'an d'aplicacions dins lo domeni de la degradacion dei biopolimèrs. En metallurgia, quauquei procès de purificacion utilizan tanben aquela reactivitat amb lei metaus per eliminar d'impuretats metallicas non desiradas. Dins l'industria nucleara, lo sulfur d'idrogèn intervèn per separar l'aiga pesuca e l'aiga normala dins lo procès de Girdler. Enfin, dins lei sistèmas d'idrodesulfuracion, lo sulfur d'idrogèn es frequentament utilizat per activar lei catalisaires permetent lo foncionament de l'unitat.
A temps passat, durant lo sègle XIX, una mescla de diidrogèn, de monoxid de carbòni e de sulfur d'idrogèn èra utilizada coma gas d'esclairatge urban. Pasmens, aqueu produch foguèt pauc a cha pauc abandonat en causa de sa toxicitat e de sei proprietats corrosivas. En quimia analitica, lo sulfur d'idrogèn foguèt utilizat durant la màger part dau sègle XX per caracterizar leis ions metallics en analisi qualitativa non organica.
Toxicologia
modificarAqueu gas es un substància toxica per fòrça organismes vivents. Dins lo cas de l'èsser uman, son odor fetida caracteristica pòu èsser detectada a partir de 0,02 ppm, mai causa una anestia olfactiva a partir de 150 ppm. L'intoxicacion entraïna una irritacion dei mucosas oculàrias e respiratòrias, d'efiechs sus lo sistèma nerviós centrau e de trèbols cardiorespiratòris. Leis efiechs letaus son rapids a partir de 1000 ppm, mai la pèrda de conoissença es frequenta a partir de 500 ppm. En França, la valor limit d'exposicion professionala es de 5 ppm per una durada de 8 h. Es similara dins la màger part dei país desvolopats, mai de valors pus feblas existisson (1 ppm ais Estats Units).
Leis exposicions pòdon aver luòc dins l'industria quimica ò lei laboratòris qu'utilizan aqueu produch. Pasmens, lei situacions pus problematicas son aquelei de personas susceptiblas d'intrar en contacte amb de quantitats importantas de matèrias organicas en descomposicion. D'efiech, l'activitat dei bacterias que degradan aquela matèria pòu emetre de quantitats importantas de sulfur d'idrogèn. Aquò es fòrça perilhós per leis aigadiers que trabalhan generalament dins de mitans quasi sarrats onte lo gas pòu se concentrar. De cas pus rars regardan leis emissions liadas ai molons d'algas encalats sus lei plajas.
Annèxas
modificarLiames intèrnes
modificarBibliografia
modificar- (en) Committee on Medical and Biological Effects of Environmental Pollutants, Hydrogen Sulfide, Baltimore, University Park Press, 1979.
- (fr) INRS, Sulfure d'hydrogène - Fiche toxicologique n° 32, consultat lo 23 de febrier de 2024, [1].
Nòtas e referéncias
modificar- ↑ (en) F. L. Suarez, J. Springfield e M. D. Levitt, « Identification of gases responsible for the odour of human flatus and evaluation of a device purported to reduce this odour », Gut, vol. 43, n° 1, julhet de 1998, pp. 100-104.
- ↑ L'acid sulfuric es tradicionalament utilizat per aquela operacion, mai en realitat, totei leis acids fòrts son eficaç.