Atòm
Un atòm (deu grèc: ἄτομος, «intrencable») qu'ei l'unitat de composicion elementària de la matèria e de las moleculas quimicas que consèrva las proprietats quimicas de l'element.
| Atòm | |
 | |
| Classificacion | |
|---|---|
| Porcion possibla mei petita d'un element quimic que conserva las proprietats quimicas | |
| Proprietats | |
| Massa | 1.67 × 10−27 a 4.52 × 10−25 kg |
| Carga electrica | zèro o carga de l'ion |
| Diamètre | 10 pm a 300 pm |
| modificar |
|

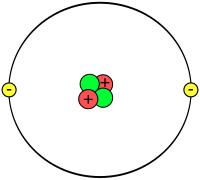
Los atòms que son compausats de fermions : neutrons, protons e electrons ligats per bosons, que son las particulas elementàrias.
Un atòm qu'ei electricament neutre e que's compausa d'un nuclèu atomic (qui pòrta cargas positivas aperadas protons e tanben (generaument) de particulas neutras (aperadas justament neutrons) e d'electrons cargats negativament e qui viran autorn deu nuclèu autorn d'ua orbita (de probabilitat de preséncia) determinada.
Quan lo nombre de protons deu nuclèu e lo nombre d'electrons en orbita e son diferents, que's tracta alavetz d'un ion.
La quasi totalitat de la massa de l'atòm qu'ei contienguda dehens lo nuclèu. Com aqueth nuclèu qu'ei 100 000 vegadas mei petit que'u son atòm, que cau logicament soslinhar que l'atòm (e donc la matèria) qu'ei mei que mei compausat de vueit.
Lo nombre de cargas positivas deu nuclèu (e donc tanben egau au nombre d'electrons qui viran autorn) qu'ei lo nombre atomic de l'atòm e que determina l'element d'aqueth atòm.
Lo concèpte d'atòm (l'idèa que la matèria que's pòt trencar en partidas elementàrias qui, eras, no's pòden pas trencar) - com lo son nom grèc ac muisha - que ho perpausat durant l'antiquitat mes non pas ho definitivament adoptada abans lo sègle XVIII.
Se lo nombre de protons (egau au nombre d'electrons) b'ei fixe e que determina l'identitat d'un element, lo nombre de neutrons eth (e donc atau lo nombre totau d'elements compausant lo nuclèu) que pòt variar. Dus atòms d'un medish element dab un nombre diferent de neutrons que constitueishen dus isotòps d'aqueth element. Un medish element que pòt comptar dab un sarròt d'isotòps.
Cèrtes isotòps que pòden estar inestables e, atau, radioactius. Dab lo temps, un isotòp radioactiu que's pòt transformar en un aute isotòp o element per transmutacion en bèth cambiar lo son nombre de particulas dehens lo nuclèu.
Descripcion d'un atòm
modificarEstructura intèrna
modificarLos atòms son estructuras electricament neutras constituïdas d'un petit nuclèu cargat positivament e d'ua nubla electronica cargada negativament. Lo nuclèu es compausat de dus tipes de particulas elementàrias :
- los protons, portaires d'ua carga positiva, qu'an ua massa de 1,672.10-27 kg.
- los neutrons, electricament neutres, qu'an ua massa de 1,675.10-27 kg.
Los electrons son portaires d'ua carga negativa e orbitan au torn deu nuclèu. Lo son nombre es egau au nombre de protons per assegurar la neutralitat electrica de l'atòm. Com son particulas hèra leugèras, dab una massa de 9,109.10-31 kg, la màger part de la massa de l'atòm es concentrada dens lo son nuclèu. Totun, la nubla electronica dicta la talha de l'atòm. En efèit, las talhas respectivas deu nuclèu e de l'atòm son aproximativament 10-15 e 10-10 m. La diferéncia es la consequéncia de la distància enter lo nuclèu e los electrons.
Istòria
modificarDeu punt de vista de la filosofia, lo concèpte e lo mot d'atòm que hon perpausats dens la Grècia Antica per Leucip e lo son discípol Democrit en bèth apujà's suber l'idea que s'un objècte e's pòt copar, aquò que vòu díser qu'ei compausat d'elements basics qui eths, no's pòden pas trencar.
Curiosament, aquesta teoria non ho pas privilegiada durant los sègles seguents e que se la preferí lo concèpte deus tres elements (tèrra, huec, aiga e aire) dinc aus sègles XVI e XVIII.
Un pas determinant que hon provesit peus tribalhs deu picard Antoine Lavoisier qui, deu punt de vista de la quimia e muishè la "conservacion de la matèria", tan vau díser que dens ua reaccion quimica, la massa deus productes reactius qu'ei egala a la massa deus productes generats per la reaccion.
Mes lo pair de la Teoria Atomica que ho John Dalton qui, en s'apujant suber las observacions quimicas, ensagè d'isolar e d'identificar l'identitat e las proprietats d'un cèrte nombre d'elements considerats indestructibles e capables de s'associar entà formar moleculas. Dalton qu'ensagè atau de hargar ua classificacion deus elements qui, pionièra, patishèva de mantua imperfeccion.
Lo quimista rus Dmitrii Mendeleiev que publiquè en 1869 la Taula periodica e s'apujant suber las descobèrtas experimentalas e empiricas qui suggereishen que, un còp classats los elements en òrdi creishent de massa, be semblan ostentar periodicament proprietats comunas qui tornan regularament.
En 1897 Joseph John Thomson descobrí l'electron en lo bèth identificar com ua particula subatomica en tot muishar que l'atòm (en contradiccion dab l'etimologia deu son nom) qu'èra en vertat divisible. Que perpausè un modèl atomic (uei considerat com faus) on explicava la neutralitat electrica de l'atòm en lo bèth descríver com un pudding anglés - l'equivalent deu clafotís occitan - caupit d'electrons negatius.
En 1909 lo modèl deu pudding que ho avalit per Ernest Rutherford qui muishè que'n bombardant ua huelha d'aur dab particulas α qu'ua petita fraccion d'aquestas particulas qu'èra desviada enlòc de traucar linearament los atòms d'aur. Entà explicar aqueth fenomèn, Rutherford que perpausè lo modèl planetari de l'atòm : un nuclèu hèra petit dab electrons en orbita autorn.
En tribalhant sus la radioactivitat, Frederick Soddy que descobrí, en 1913, que per cada element, que pòden existir atòms diferents : los isotòps. La medisha annada, Niels Bohr que muishè que los electrons be son situats sus orbitas determinadas.
En 1916, Gilbert Newton Lewis qu'expliquè que los atòms e's ligan au mejan deus lors electrons.
Durant las annadas 1920, lo modèl planetari dab electrons virant suber orbitas precisas que ho remplaçat per la nocion de nubla d'electrons e de probabilitat de preséncia autorn d'ua orbita.
A partir de las annadas 1950, los scientifics qu'explorèn lo monde jusatomic de las particulas elementàrias (dab la descobèrta deus quarks, compausants deus protons e deus neutrons, e deus leptons, estant l'electron lo mei famós enter eths) mercés au desvolopament deus accelerators de particulas qui permeten d'accelerar los atòms en bèth generar impactes enter eths.
Ligams intèrnes
modificar- Compausants de l'atòm : nuclèu atomic, neutron, proton ; particula elementària : fermion
- Radioactivitat, isotòp, deutèri, triti, fusion nucleara, fission nucleara, accelerator de particulas, aiga pesuga
Bibliografia
modificar- {{{títol}}}. Harvard University Press. ISBN 0-674-01495-2.
- {{{títol}}}. Oxford University Press. ISBN 0-19-851971-0.
- {{{títol}}}. Cornell University Press. ISBN 0-8014-0333-2.
- {{{títol}}}. DIANE. ISBN 0-87169-924-9.